
De forma similar a lo analizado en el comportamiento de los sólidos ante el calor, se pueden definir algunas de las principales características de los líquidos y gases.
Para explicar como se comportan los líquidos combustibles ante el calor, parece oportuno realizar con carácter previo algunas aclaraciones importantes.
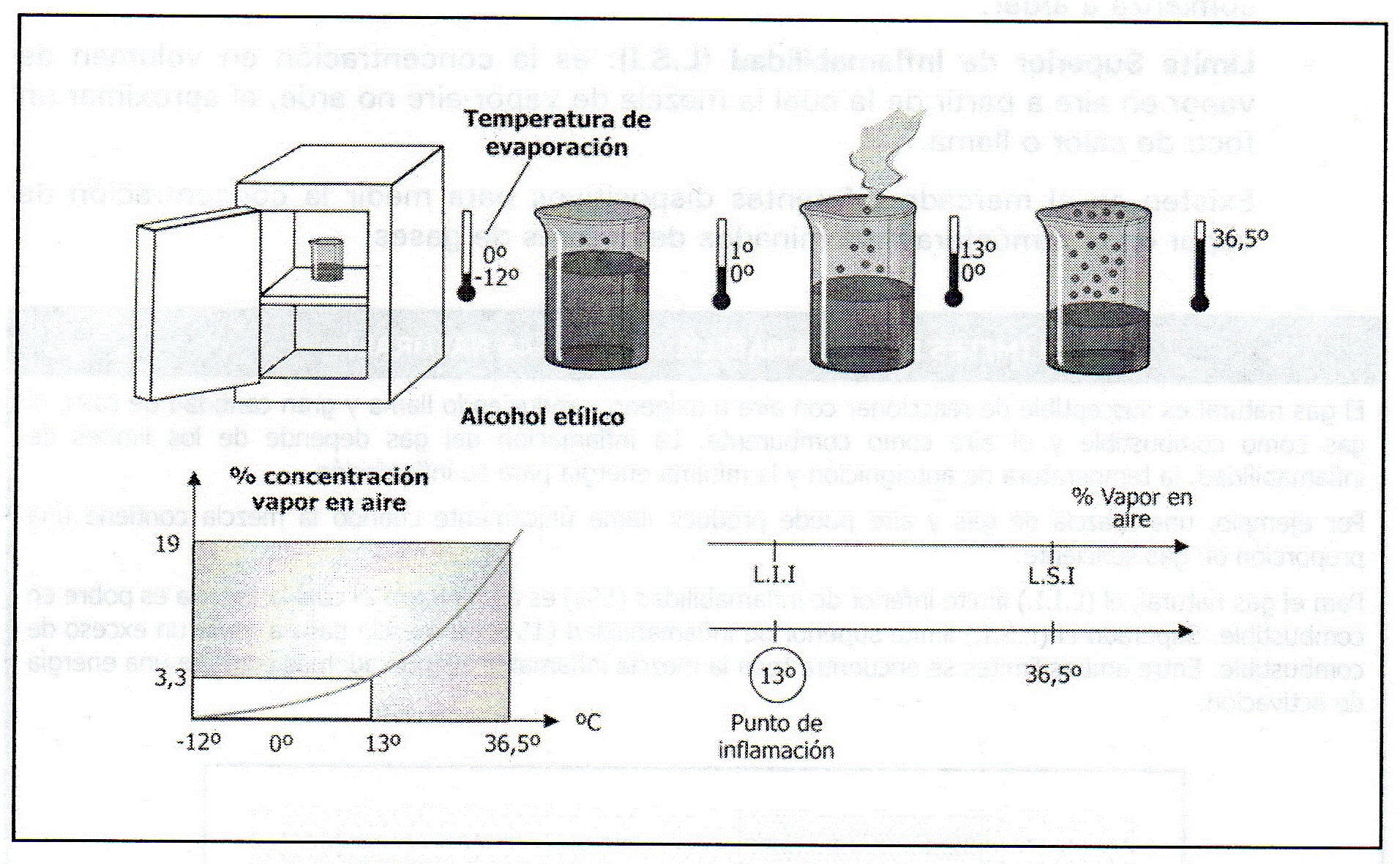
Los líquidos comienzan a evaporarse a partir de una temperatura determinada, denominada «punto de inflamación». Tal y como se verá posteriormente, la concentración de estos vapores en el aire constituyen el «límite inferior de inflamabilidad».
En general, a cualquier temperatura superior a la de evaporación, muchas partículas de la superficie del líquido adquieren la energía suficiente para pasar al estado de vapor.
En función del punto de inflamación, se pueden clasificar los líquidos en:
a) Líquidos inflamables: es el líquido cuyo punto de inflamación es inferior a 38 °C.
b) Líquido combustible: es el liquido cuyo punto de inflamación es superior a 38 °c.
Al calentar un líquido y elevar su temperatura, la fase líquida aumenta su volumen y habrá muchas más moléculas que adquieran la energía suficiente para pasar al estado de vapor. Si aportamos el calor suficiente para que el líquido alcance la temperatura de ebullición, inmediatamente después de haber absorbido el calor latente de evaporación, se transforma directamente en gas.
El volumen de la masa de gas es muchísimo más grande que la misma masa correspondiente al líquido. Por ejemplo, en el caso concreto del agua es 1700 veces
mayor.
A la temperatura de ebullición, los vapores emanados por el líquido ejercen una presión sobre las paredes del recipiente de 1 atmósfera. Un ejemplo de ello es el agua cuando adquiere la temperatura de 100 °C en una olla a presión que ejerce 1 atmósfera de presión sobre sus paredes interiores; si aumenta la temperatura del líquido, la presión ejercida por los vapores será superior que la presión atmosférica.
Los combustibles líquidos y gaseosos comparten una característica que no es propia de los combustibles sólidos: el rango de inflamabilidad.
Para que exista inflamabilidad (término diferente a la combustión), la materia tiene que estar en estado gas. En los líquidos siempre existe en su superficie un porcentaje del mismo en fase gas, aunque sea mínimo (es lo que se denomina presión vapor o el equilibrio entre lo que se evapora y lo que se condensa). ,
Los límites de inflamabilidad se expresan en porcentaje de gas inflamable con respecto al aire, de esta manera se define:
– Límite Inferior de Inflamabilidad (L.|.I): se define como el porcentaje de concentración de vapor en aire, a partir del cual con una mínima fuente de calor comienza a arder.
– Límite Superior de Inflamabilidad (L.S.|): es la concentración en volumen de vapor en aire a partir de la cual la mezcla de vapor-aire no arde, al aproximar un
foco de calor o llama.
Existen en el mercado diferentes dispositivos para medir la concentración de vapor en la atmósfera denominados detectores de gases.
Habitualmente se someten los gases al efecto del calor, en estas condiciones es muy importante saber responder a la pregunta: ¿Qué ocurre cuando se calienta o aumenta la temperatura del gas?
Si el gas está comprimido sigue la Ley de Gay-Lussac. Al elevarse la temperatura, como el volumen del recipiente sigue siendo el mismo, aumenta la presión en la misma proporción. El peligro existe cuando el recipiente no aguanta la presión del gas. Para prevenir esta circunstancia, se ha diseñado la válvula de seguridad como sistema de alivio de presión.
Si el gas está licuado, incluyendo los gases criogénicos, el proceso es más complejo:
1° La fase vapor se comporta como un gas comprimido, es decir, aumenta la presión.
2° La fase líquida tiende a dilatarse, es decir, a aumentar su volumen comprimiendo más la fase vapor, y generando así más presión.
3° Dado que ha aumentado la temperatura de la fase líquida, la presión de vapor también habrá aumentado. Esto quiere decir que habrá más moléculas en
estado de vapor.
Como consecuencia de todo ello, con un incremento pequeño de temperatura se produce un aumento enorme de presión.
El problema fundamental que se plantea es que se produzcan sobrepresiones en el interior del recipiente contenedor causadas por el aumento de temperatura. Para prevenirlo, las reglamentaciones toman una serie de medidas:
– Por una parte, el recipiente contenedor estará diseñado para soportar una determinada presión denominada presión de prueba. Llevará una válvula de seguridad, cuya presión de tarado puede ser regulada y ajustada, un valor específico: Presión de disparo de la válvula de seguridad; a esa presión se producirá la apertura de la válvula permitiendo la salida al exterior de la fase gaseosa del gas.
– Por otro lado, se quiere almacenar un contenido que, habitualmente, será un gas que se encontrará en el interior del recipiente en forma de: gas licuado, comprimido, disuelto a presión o criogenizado. La cuestión a resolver es la cantidad de gas que debemos introducir, es decir, el grado de llenado (cantidad de gas almacenada, expresada en kg por litro de capacidad de recipiente) y en qué condiciones de presión y temperatura de servicio.


Nano Sanhueza Troncoso liked this on Facebook.
Hugo Reyes Hernandez liked this on Facebook.
Julius Tovar liked this on Facebook.
Andrew Garcia liked this on Facebook.
Cesar Hernandez liked this on Facebook.
Heriberto Beltran Ruiz liked this on Facebook.